Im Laufe der Medizingeschichte gibt es ein immer wiederkehrendes Muster im Bereich der Ursachenforschung. Erst tauchen Krankheitsfälle auf, die von der Bevölkerung und den Ärzten genauestens beobachtet werden, dann, ab einer gewissen Zahl von Krankheitsfällen, zeichnen sich typische Krankheitsverläufe ab, dabei entstehen häufig Krankheitsnamen, die für das jeweilige Krankheitsbild charakteristisch sind, wie z.B. Gelbfieber oder Fünftagefieber. Nur wenn der Krankheitsverlauf typisch ist, kann man Rückschlüsse auf die Krankheit und gegebenenfalls auch auf die Behandlung schließen.
Jedoch gibt es auch Krankheiten, wo bereits Rückschlüsse auf den Überträger gezogen werden können. So sind Krankheitsnamen entstanden, wie bei dem Läuserückfallfieber oder Zeckenbissfieber, wo man zunächst dachte, dass die Insekten ursächlich seien.
In alten Vorstellungen wurde man durch den Speichel dieser Insekten (Vektoren) krank.

Doch mit der Erfindung des Mikroskops änderte sich dies. Durch Sezierungen von Insekten und durch Übertragungsversuche konnte man, unter zur Hilfenahme des Mikroskops, Erreger bestimmen und verfolgen.
So besitzen heute die meisten Krankheiten einen Bezug zu einem Erreger. Als Beispiel sei hier genannt, dass das Zeckenbissfieber durch Rickettsia rickettsii ausgelöst wird.
Doch die Erkenntnisse wachsen weiter und so ist nicht immer ein zusammengehöriges Auftreten auch ein Erkrankungsgrund, wie das folgende Beispiel zeigt.
Flussblindheit
Die Flussblindheit wird auch als „Onchozerkose oder Onchozerkiasis“ bezeichnet, weil man lange Zeit glaubte, dass der Fadenwurm Onchocerca volvulus die Augen schädigen würde oder aber zumindest die toten Würmer das Immunsystem so fehllenken würden, dass die Augen-Hornhaut geschädigt wird. Doch neuere Forschung zeigt, dass ein Bakterium namens Wolbachia in den Nematoden dafür verantwortlich ist. Dies erklärt auch warum nicht jede Infektion mit Mikrofilarien von Onchocerca volvulus zu Augenschäden führt.
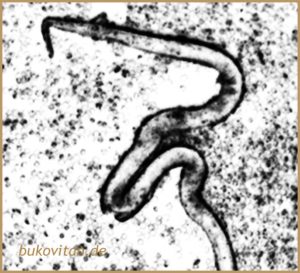
Um es nochmal zu verdeutlichen, es gibt eine Erkrankung, die sich Flussblindheit nennt, weil der Bevölkerung auffiel, dass Menschen in Flussnähe besonders häufig davon betroffen sind. In den Flüssen schlüpft die Kriebelmücke, diese kann den Fadenwurm Onchocerca volvulus übertragen, dieser Wurm wiederum besitzt in seinem Inneren häufig Wolbachia-Bakterien, die das Immunsystem so aggressiv machen, dass es gegen die Augen-Hornhaut vorgeht.
Eric Pearlman von Case Western Reserve University in Cleveland, Ohio und Kollegen: „Bei der Arbeit mit einem genetisch veränderten Maus-Modell für die Erforschung der menschlichen Flussblindheit haben wir nun festgestellt, dass es diese Wolbachia Erreger das Immunsystem verschlimmern.“
Saint Andre, A. V. et al. The role of endosymbiotic Wolbachia bacteria in the pathogenesis of river blindness. Science295, 1892 – 1895 (2002).
Knight, J. Meet the Herod bug. Nature412, 12 – 14 (2001).
Phylogenetische Analysen zeigten, dass die Wolbachien den Rickettsien nahestehen.
Doch kommen wir noch einmal zurück zu dem Fadenwurm Onchocerca volvulus. In den letzten Monaten wurde durch Dr. Allan MacDonald immer wieder darauf hingewiesen, dass dieser Wurm in der Spinalflüssigkeit von MS-Patienten gefunden wurde und dass man dort Borrelien-DNA gefunden hat. Auf diesen Sachverhalt komme ich im späteren Verlauf des Textes noch einmal zusprechen.
Fadenwürmer (Nematoden) besitzen in ihrem Verdauungstrakt zahlreiche Bakterien, Pilze und Viren. Und auch Fadenwürmer können durch Parasiten beeinflusst werden.
Symbiontische Bakterien in Würmern stellen z.B. B-Vitamine bereit.
So ist ein neues Forschungsgebiet entstanden, das versucht die Darmflora der krankmachenden Würmer z.B. Mansonella perstans erst durch Antibiotika (Doxycyclin) zu verändern, bestenfalls zu schädigen und danach durch Wurmmittel den Wurm abzutöten.
A Randomized Trial of Doxycycline for Mansonella perstans Infection, New England Journal of Medicine, 361, 2009
Langworthy, N. G. et al. Macrofilaricidal activity of tetracycline against the filarial nematode Onchocerca ochengi: elimination of Wolbachia precedes worm death and suggests a dependent relationship. Proceedings of the Royal Society B267, 1063 – 1070 (2002).
Achim Hörauf, Sabine Mand, Dietrich W. Büttner: Doxycyclin zur Chemotherapie der Filariosen: Elimination von Wolbachien, essenziellen bakteriellen Endosymbionten in den Würmern . In: Deutsches Ärzteblatt. Band 100, Nr. 37. Deutscher Ärzte-Verlag, 12. September 2003, S. A-2383 / B-1988 / C-1875.
Aber nicht nur symbiontische Bakterien leben in Würmern, auch Bakterien, die die Würmer als Taxi benutzen werden immer häufiger entdeckt.
Lachsvergiftungs-Krankheit (Salmon-Poisoning-Disease, abgekürzt: SPD)
Lachsvergiftungskrankheit (SPD) ist eine akute, fiebrige, bis tödliche Krankheit bei Hunden. Das Bakterium Neorickettsia helminthoeca befindet sich in den Eiern eines Saugwurms/Trematode (Nanophyetus salmincola) und sinkt im Wurmei auf den Grund des Flusses, wo Flussschnecken (Oxytrema silicula) die Wurmeier aufnehmen. Schneckenfressende Fische nehmen die Saugwürmer auf und werden wiederum von Hunden, Bären und Luchsen gefressen.

So gelangt der Saugwurm mit samt den Neorickettsien in den Hund, wo es dann zur Lachsvergiftungskrankheit (SPD) kommt.
Skrjabin, K. J., and Podjapolskaja, W. P., (1931).Nanophyetus schikhobalowi, n. sp., ein neuer Trematode aus dem Darm des Menschen. Zlb. Ba/ct. I. Orig., 119: 294–297.
Aber nicht nur die aufwendigen Lebenszyklen und Anpassungen an den Wirt sind faszinierend auch ihre geschickte Wirtsmanipulation ist aufsehend erregend, wie der folgende Text berichtet.
Kleiner Leberegel (Dicrocoelium dendriticum, Synonym: Dicrocoelium lanceolatum)
Der kleine Leberegel gehört ebenfalls zu den Saugwürmern (Trematoden). Auch wenn der gesamte Lebenszyklus besonders ist, so möchte ich an dieser Stelle nur einen Teil davon beleuchten.

Der zweite Zwischenwirt vom kleinen Leberegel ist die Ameise, wo einer der Zerkarien (so heißt der Leberegel in diesem Stadium) ins Unterschludganglion wandert um, im späteren Verlauf, ein Verbeißen der Ameise an einer Blatt- bzw. Halmspitze hervorzurufen. Das Unterschlundganglion bildet sich aus den drei Nervenzellknoten, durch die die Mundwerkzeuge der höheren Insekten versorgt werden. Nur eine einzige Zerkarie begibt sich in den Nervenzellknoten, wo sie auch stirbt. Die Zerkarien (die meisten befinden sich in der Leibeshöhle der Ameise) beeinflussen das Nervensystem und führen in der Folge zu einer Verhaltensänderung der Ameise. Die Ameise fürchtet sich nicht mehr vor Kälte und Dunkelheit und tut alles um vom nächsten vorbeikommenden Weidetier gefressen zu werden. Sie klettert Halme hinauf, bevorzugt wohlschmeckende Blüten, verbeißt sich dort und wartet darauf gefressen zu werden und mit ihr die kleinen Leberegel in der Lebeshöhle. Durch dieses Opfer, welches die eine Zerkarie auf sich nimmt, haben die restlichen Zerkarien bzw. kleinen Leberegel bessere Überlebenschancen.

Die ist ein Beispiel von Vielen, wo das Verhalten eines parasitierten Wirtes in auffälliger Weise verändert wird.
Zerebrale Nematodiose (Cerebrospinalnematodiasis)
Die zerebrale Nematodiose (Cerebrospinalnematodiasis) ist eine Erkrankung mit Fadenwürmern bei Mensch und Tier, wo die Wurmlarven in den Bereich des Gehirns vorgedrungen sind.
Dieses Verhalten ist besonders bei Baylascaris procyonis dem Waschbärspulwurm bekannt.
Deeb B.J. and Di Giacomo R.F. Cerebral larva migrans caused by Baylascaris sp. in pet rabbits. J Am Vet Med Assoc 1994; 205:1744-1747
Doch in den letzten Monaten liest man immer häufiger: „Lyme Bacteria Hides Inside Parasitic Worms, Causing Chronic Brain Diseases“, zu deutsch: „Lyme-Borreliose-Bakterien verstecken sich in parasitären Würmern und verursachen chronische Gehirnkrankheiten“. Dr. Allan MacDonald fand zwei Borreliose-Erreger-Stämme, darunter Borrelia burgdorferi der Erreger der Lyme-Krankheit, in parasitären Nematoden (Fadenwürmern, Wurm-Eiern oder Larven), diese befanden sich im Gehirngewebe von neunzehn verstorbenen Patienten. Diese mikroskopisch kleinen Würmer besitzen als Endosymbionten Borrelien, was bedeutet, dass die Borrelien-Bakterien in den Würmern leben. Ein Zeckenbiss bringt die Nematoden in den menschlichen Körper, so Dr. Allan MacDonald.
Dies stellte Dr. Allan MacDonald auf dem Capitol Hill im Rayburn House Office Building im Jahre 2016 vor.
„Sowohl die Würmer als auch die Borrelia-Erreger können verheerende Hirnschäden verursachen“ sagte dort Dr. MacDonald.
MacDonald’s Präsentation kann hier abgerufen werden: https://vimeo.com/166688480
Fragen über Fragen
Wie erfolgt die Borrelien-Aufnahme durch die Würmer (Mikrofilarien)?
Dringen die Borrelien aktiv in die Würmer ein?
Durch den Saugakt der Zecken wissen wir, dass Borrelien als intraerythrozytäre Passagiere reisen. Verschluckt also der Wurm bei der Aufnahme von roten Blutkörperchen die Borrelien?
Was macht ein Wurm im Gehirn? Das Gehirn ist kein geeigneter Platz für einen Wurm, es sei denn er beabsichtigt den Wirt zu manipulieren und die anderen seiner Art in den nächsten Wirt zu bringen. Das Gehirn ist für einen Wurm meistens eine Einbahnstraße, es sei denn, ein großes Tier, wie ein Löwe, frisst einen Infizierten komplett auf.
Auch für mich denkbar, dass die Bakterien im Inneren des Wurms den Wurm so manipulieren, dass er sich in das Gehirn begibt. Und so gelange ich wieder zur Überschrift des heutigen Artikels: Die Würmer werden von einigen Bakterien als Taxi benutzt, im Gehirn können sie dann aussteigen und das machen, was ihre Biologie ihnen vorgibt.