Meine persönliche Meinung, dass die Borreliose (eine bestimmte Erkrankungsform mit einem Bakterium) häufig vorkommt und schwierig ist in der Behandlung, fand in der Vergangenheit oftmals Zündstoff für viele Diskussionen. Meine Haltung zu diesem Themenkomplex beruht auf einem durchgearbeiteten Berg von alter Spirochäten-Literatur, einer Vielzahl von gelesenen Studien und einer immensen Zeit am Dunkelfeldmikroskop.
Ich sage: „Es gibt keinen 100% sicheren standardisierten Labortest, ob man Borreliose hat oder nicht.“
In der Fachliteratur findet sich, bei vergleichenden Untersuchungen (serologischer Nachweis einer Borrelieninfektion), kein einheitliches Ergebnis in den Resultaten zwischen den Testsystemen. In der Tiermedizin gibt es mehr Einträge zu den Testsystemen (nach meiner Einschätzung), als in der Humanmedizin, obwohl die Erkenntnisse in der Tiermedizin immer in Bezug zu den Ergebnissen der Humanmedizin stehen.
Quellen:
Bhide, M., Yilmaz, Z., Golcu, E., Torun, S., Mikula, I., 2008. Seroprevalence of anti-Borrelia burgdorferi antibodies in dogs and horses in Turkey. Ann. Agric. Environ. Med. 15
Hunfeld, K.P., Stanek, G., Straube, E., Hagedorn, H.J., Schorner, C., Muhlschlegel, F., Brade, V., 2002. Quality of Lyme disease serology. Lessons from the German Proficiency Testing Program 1999-2001. A preliminary report. Wien. Klin. Wochenschr. 114 (13-14)
Schönert, S., Grabner, A., Heidrich, J., Schönberg, A., Nöckler, K., Bahn, P., Luge, E., Brem, S., Müller, W., 2002. Lyme-Borreliose beim Pferd? – Vergleichende Betrachtungen zum direkten und indirekten Erregernachweis. Prakt. Tierarzt 83 (12), 1064-1068.
May, Katharina, 2009. Enzym-Immunoassay und Western Blot zum Nachweis von Antikörpern gegen Borrelia burgdorferi sensu lato bei gesunden Pferden. Inaugural-Dissertation der Vetsuisse-Fakultät, Universität Zürich.
Wojciechowska-Koszko, L., Maczynska, L., Szych, Z., Giedrys-Kalemba, S., 2011. Serodiagnosis of borreliosis: indirect immunofluorescene assay, enzyme-linked immunosorbent assay and immunoblotting. Arch. Immunol. Ther. Exp. (Warsz.) 59 (1); 69-77.
Venner, M., Deegen, E., 1996. Interpretation von Borrelia burgdorferi Antikörpertitern beim Pferd unter Berücksichtigung der Kenntnisse zur Borreliose beim Menschen – eine Literaturübersicht. Pferdeheilkunde 12, 6 (Nov. Dez.) 865-873
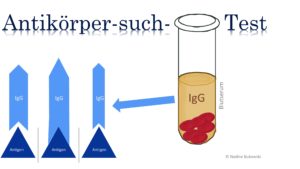


Der ELISA wird als Antikörper- Suchtest bei Verdacht auf eine Borreliose eingesetzt. Ein fest an die ELISA-Platte (Mikrotiterplatte) gebundener Borrelien-Anteil (Antigenhomogenat, meist die Antigene DbpA und OspC) dient dabei als Bindungsort für die im Patientenserum befindlichen Antikörper. Nur wenn die Antikörper passen kommt es zum positiven Ergebnis (Antigen-Antikörper-Komplex).
Serologische Tests messen die IgG- und IgM-Antikörper in den Körperflüssigkeiten der Patienten und können somit nur indirekt wiedergeben, ob es eine Infektion gegeben hat oder diese weiterhin besteht und darin besteht auch schon die Fehlerquelle.
Stufendiagnostik (abgeschaut von dem Hepatitis-Testsystem), doppelstufiges System
Zur Beantwortung der Frage in welchem Krankheitsstadium sich ein Patient befindet nach positivem oder grenzwertigem ELISA-Test (Frühstadium, chronischer Zustand bei Erregerpersistenz oder Serumnarbe nach sogenannter „abgeheilter Lyme-Borreliose“) wird ein Immunoblot im Westernblotverfahren durchgeführt. Hierbei werden durch Auftrennung der Borrelienantigene (Ganzzell-Lysat ) in der Gelelektrophorese einzelne Banden dargestellt (verschiedene Proteinfraktionen) und nun können prinzipiell die Patientenantikörper gegen charakteristische Partialantigene von B. burgdorferi andocken. Der Nachweis der gebundenen Patientenantikörper erfolgt mittels Zugabe von enzymmarkierten Antihuman-IgM- und Antihuman-IgG-Immunglobulinen. Dabei werden fertig hergestellte Teststreifen eingesetzt, die mit dem Patientenserum, welches die gesuchten Antikörper enthalten könnte, beschichtet werden. Die IgG- oder IgM-Antikörper binden an ihren entsprechenden (auf dem Immunoblot befindlichen) Borrelienproteinen. Im nächsten Schritt werden enzymgekoppelte Anti-human-IgG oder -IgM und ein enzymspezifisches Substrat hinzugefügt, sodass der ganze Antikörperkomplex angefärbt wird. Die dadurch entstehenden Banden stehen mit ihrer Dicke quantitativ für die Antikörpermenge im Patientenserum, so die Theorie.
Alle beiden Tests sind aber auch fehleranfällig, z.B. können Kreuzreaktionen mit anderen Bakterien, vor allem mit anderen Spirochäten wie Treponemen oder Rückfallfieber-Spirochäten, falsch-positive Ergebnisse liefern.
Das Grundproblem ist aber, dass die Borrelien generell sehr variabel sind in ihrem Aufbau, dies nennt man auch: antigene Heterogenität des Erregers. Antikörper bei Borreliose-Patienten lassen sich unteranderem nur dann nachweisen, wenn auch das korrespondierende Antigen im Testansatz vorhanden ist. Also mit anderen Worten, wenn das Labor den passenden Testkit auswählt. Man kann demnach falsch-negative Ergebnisse erhalten, wenn das diagnostisch eingesetzte Borrelienisolat (z.B. ein amerikanischer Stamm „Borrelia burgdorferi USA“) wenig Antigengemeinschaft mit demjenigen besitzt, welches zur Infektion des Patienten (z.B. ein europäischer Stamm, z.B. „Borrelia burgdorferi CH“) geführt hat. Daher sind die unterschiedlichen Ergebnisse zwischen den einzelnen Laboratorien und den jeweiligen Testverfahren verschiedener Hersteller nicht selten und so zu erklären.
In Europa besteht eine große Heterogenität bei den Borrelienspezies und ihren Oberflächenantigenen, was ein Problem für den Antikörpernachweis darstellt. Insbesondere für DbpA und OspC liegen nur jeweils 40-44 % und 54-68 % identische Aminosäuresequenzen vor.
Quellen:
Wilske, B. and V. Fingerle (2005) „Lyme Borreliose Diagnostik. Der Mikrobiologe“ 2005. 15. Jahrgang: p. 209-220.
Lünemann, J.D. and A. Krause (2004) „Heterogenität von Borrelia burgdorferi: Äthiopathogenetische Relevanz und klinische Implikation.“ Zeitschrift für Rheumatologie, 2003. 62(2): p. 148-54
Hassler D, Zöllner L, Haude M, Hufnagel HD, Sonntag HG. (1992) “Lyme-Borreliose in einem europäischen Endemiegebiet.“ Dtsch med Wschr.;117:767-774.
Vasiliu V, Herzer P, Rossler DE, Lehnert G, Wilske B. Heterogeneity of Borrelia burgdorferi sensu lato demonstrated by an ospA-type-specific PCR in synovial fluid from patients with Lyme arthritis. Med. Microbiol. Immunol. (Berlin) 1998; 187 (2); 97-102
Barbour AG, Tessier SL, Hayes SF. Variation in a major surface protein of Lyme disease spirochetes. Infect. Immun. 1984; 45; 94-100
Shanafelt M, Anzola J, Soderberg C, Yssel H, Turck CW, Peltz G. Epitopes on the outer surface protein A of Borrelia burgdorferi recognized by antibodies and T cells of patients with Lyme disease. Eur. J. Immunol. 1992; 148; 218-224
https://www.deutsches-chroniker-labor.de/images/Download/Laborauftraege_2019/Anforderungsschein_Borreliose_2019.pdf
Im Jahr 2017 gab es eine Untersuchung zur Bestimmung von Serumantikörpern von Pferden des Bayerischen Haupt- und Landgestüts Schwaiganger gegen B. burgdorferi s.l.. Da die Ergebnisse teilweise viel zu hoch und zudem unterschiedlich ausfielen, wurden die Testsysteme (IFAT, Immunblot und zweier ELISA-Testsysteme) generell erst mal als „verwirrend“ deklariert.
Zitat: „Die widersprüchlichen Resultate der serologischen Untersuchungen wichen erheblich von der diagnostischen Realität ab und ließen keine gesicherten Aussagen über die Immunantwort der Pferde zu.“
Quelle: Inaugural-Dissertation zur Erlangung der Doktorwürde der Tierärztlichen Fakultät der Ludwig-Maximilians-Universität München Nachweis spezifischer Antikörper gegen Borrelia burgdorferi in equinen Serumproben aus dem Bayerischen Haupt- und Landgestüt Schwaiganger unter Berücksichtigung aktueller Kriterien der Diagnostik
Das Grundproblem ist, dass ein Labor (egal welcher Art) nur die Hinweise auf eine Infektion mit einigen wenigen Borrelien-Arten zusammenstellen kann und dies bedeutet aber für den Patienten, dass die Erkrankung, nämlich die Borreliose, nicht von diesen Hinweisen abgeleitet werden kann. Um es einfacher zu formulieren: Ein Erregernachweis oder ein Antikörpernachweis beweist niemals, dass ein Symptom auch von der Infektion herrührt. Und das ist das Fundament auf dem wir uns bewegen und warum ich so zahlreiche E-Mails bekomme, wo zwar positive Antikörpertests vorliegen, aber dennoch das positive Testergebnis zu keinerlei Therapie führt. Oder in meinem eigenen persönlichen Fall: Als es mir sehr schlecht ging, fand man keine Antikörper und mit zunehmender Besserung wurden Antikörper gegen Borrelia burgdorferi (heute: Borreliella burgdorferi) gefunden.
Wie kommt es zu der diagnostischen Problematik, dass man keine einheitlichen Aussagen treffen kann?
Einwanderung der Borrelien in die Lymphozyten
Dass Borrelien in Lymphozyten einwandern, ist keine Mutmaßung von mir, sondern wissenschaftlich belegt, wie ich im weiteren Verlauf des Textes zeigen werde.
Borrelien entziehen sich sehr komplex dem Immunsystem durch ihr Verhalten:
Borrelia burgdorferi (Borreliella burgdorferi) ist generell in der Lage in Zellen einzudringen, außerhalb von Zellen zu überdauern (als Kugelform bzw. sogenannte „Gemma“ und „Granula“), sich an Zellen zu kleben (BmpA-Protein) und ihre Oberfläche (Oberflächenantigene, „outer surface proteins“ (Osp)) immer wieder zu verändern. Dies macht Borrelia burgdorferi zu einem absoluten Multiplayer im Organismus. Sie haften an Zellen an, z.B. an Thrombozyten oder Lymphozyten und man findet sie in einer Vielzahl von verschiedenen Zellen (Endothelzellen, Fibroblasten, Synovialzellen, Muskelzellen und in Kollagenfasern). Außerdem kann man sie in verschiedenen Organen antreffen (Gelenke, Augen, Zentralnervensystem, da sie in extrazellulären Flüssigkeiten (synoviale und cerebrospinale Flüssigkeit) Nahrung finden).
Quellen:
Comstock, L.E., Thomas, D.D., 1991. Characterization of Borrelia burgdorferi invasion of cultured endothelial cells. Micro.Patho. 10 (2), 137-148.
Comstock LE, Thomas DD. Penetration of endothel cell monolayers by Borrelia burgdorferi. Infect. Immun. 1989; 57; 1626-1628
Pachner, A.R., Basta, J., Delaney, E., Hulinska, D., 1995. Localization of Borrelia burgdorferi in murine Lyme borreliosis by electron microscopy. Am. J. Trop. Med. Hyg. 52 (2), 128-133.
Teale, F. H. 1935 Some observations on the relative importance of the reticuloendothelial tissues and the circulating antibody in immunity. J. Immunol., 28, 133-182.
Hechemy, K.E., Samsonoff, W.A., Harris, H.L., Mc Kee, M., 1992. Adherence and entry of Borrelia burgdorferi in Vero cells. J. Med. Microbiol. 36, 4229-4238.
Kraiczy, P., Skerka, Ch., Kirschfink, M., Brade, V., Zipfel, P.F., 2001. Immune evasion of Borrelia burgdorferi by acquisition of human complement regulators FHL-1/reconectin and Factor H. Europ. J. Immunol. 31 (6), 1674-1684.
Klempner, M.S., Noring, R., Rogers, R.A., 1993. Invasion of human skin fibroblasts by the Lyme disease spirochete, Borrelia burgdorferi. J. Infect. Dis. 167 (5), 1074-1081.
Ma, Y., Sturrock, A., Weis, J.J., 1991. Intracellular localization of Borrelia burgdorferi within human endothelial cells. Infect. Immun. 59 (2), 671-678.
Wie schon erwähnt kann Borrelia burgdorferi aber auch bestimmte Immunzellen eliminieren. Borrelia burgdorferi wandert dabei aktiv in die Lymphozyten (B- und T-Lymphozyten) ein und zerstört diese Abwehrzellen. Häufig besitzen Borreliosepatienten deshalb erniedrigte Lymphozytenwerte (was aber keine Borreliose beweist und auch nicht bei jedem zu finden ist).
Quelle:
Dorward, D.W., Fischer, E.R., Brooks, D.M., 1997. Invasion and cytopathic killing of human lymphocytes by spirochetes causing Lyme disease. Clin. Infect. Dis. 1997 Jul; 25 Suppl 1: S2-8
https://www.ncbi.nlm.nih.gov/pubmed/9233657
https://www.jstor.org/stable/4460119?seq=1#page_scan_tab_contents
Liang, F.T., Jacobs, M.B., Bowers, L.C., Philipp, M.T., 2002. An immune evsion mechanism for spirochetal persistance in Lyme borreliosis. J. Exp. Med. 195 (4), 415-422.
Liang, F.T., Brown, E.L., Wang, T., Iozzo, R.V., Fikrig, E., 2004. Protective niche for Borrelia burgdorferi to evade humoral immunity. Am. J. Pathol. 165, 977-985.

Nun sind aber genau diese Abwehrzellen für die Produktion von Antikörpern notwendig. Eine B-Zelle (B-Lymphozyt) wird nach Antigenkontakt zur antikörper-produzierenden Plasmazelle. Daher wundert es mich auch nicht, wieso Antikörpertests häufig versagen. Dazu muss man auch bedenken, dass immer neue Borrelien auftauchen, die entweder einem eigenen Stamm angehören oder zumindest vom „Vorwirt“ geprägt worden sind.
Quelle:
https://de.wikipedia.org/wiki/B-Lymphozyt
https://www.ncbi.nlm.nih.gov/pubmed/?term=borrelia+miyamotoi+hanover
Zumindest von der Syphilis weiß man, dass der Vorwirt einen enormen Einfluss auf die Agressivität und damit auch auf die Zusammensetzung der Proteine nimmt. So kann der Aufenthalt einer Syphilis-Spirochäte im Gehirn der Maus die Virulenz dieser Spirochäte so verändern, dass sie neurotrop wird und bei Überimpfung zu neurologischen Reaktionen beim Kaninchen führt.
Quelle:
STOKES, J. H., BEERMAN, H. AND INGRAHAM, N. R. 1944 Modem Clinical Syphilology, 3rd ed., W. B. Saunders Co., Philadelphia.
IgM- und IgG-Antikörper
Im Allgemeinen sagt man, dass erst zwei bis vier Wochen nach der Einschleusung der Borrelien in den Körper die Antikörper der Klasse IgM (Immunglobulin M) in nachweisbaren Konzentrationen vorhanden sind. Der Maximal-Wert liegt bei sechs bis acht Wochen und dann sinken die IgM-Antikörper „normalerweise“ wieder ab. Leider gilt dies aber nur für einen sehr geringen Prozentsatz der Menschen, denn zum einen muss es sich hierbei um eine Erstinfektion handeln, dann muss die Borrelie verwandtschaftlich nah einem Laborstamm stehen (sonst findet man keine passenden Antikörper) und dann sind auch noch IgM-Antikörper sehr anstrengend für den Körper, so dass er viele Ressourcen dafür benötigt. Und nicht zuletzt müssen die Lymphozyten einwandfrei funktionieren, was aber bei einem großen Teil der Bevölkerung durch das EB-Virus, andere Viren, Chlamydien, Schwermetalle, Pestizide, Wurmerkrankungen und durch den Medikamentenzusatz: Titandioxid extrem erschwert sein dürfte.
Offiziell heißt es auch (diese Meinung teile ich aber nicht), dass „rheumatischen Erkrankungen auch zu IgM-Antikörpern (gegen Borrelien) führen, ohne dass eine akute Erkrankung besteht. Und je älter man ist, desto häufiger tritt dieses Phänomen auf.“
Quelle dieser Meinung:
https://www.netdoktor.de/interview/antikoerper-sind-kein-beweis-fuer-eine-borreliose/
Das halte ich aber für grob fahrlässig, zum einen weil ja mit zunehmendem Alter auch die Wahrscheinlichkeit ansteigt sich mit einer Borreliose anzustecken und zum anderen sind viele der rheumatischen Erkrankungsformen ein Symptom der Borreliose. So sehe ich das jedenfalls.
Hier bitte meinen Haftungsausschluss im Impressum beachten. Ich schreibe nur meine persönliche Meinung.
Kommen wir zu den IgG-Antikörpern. Antikörper der Klasse IgG (Immunglobulin G) sind erst nach sechs bis acht Wochen nachweisbar, so die offizielle Stellungnahme.
Quellen:
Craft, J.E., Grodzicki, R.L., Steere, A.C., 1984. Antibody response in Lyme disease: evaluation of diagnostic tests. J. Infect. Dis. 149, 789-795.
Christen, H.J., Hanefeld, F., Eiffert, H., Thomssen, R., 1993. Epidemiology and clinical manifestations of Lyme Borreliosis in childhood. A prospective multicenter study with special regard to neuroborreliosis. Acta. Paediatr. Suppl. 386, 1-76.
Frey, A.B., Rao, T.D., 1995. Single exposure of mice to Borrelia burgdorferi elicits immunoglobulin G antibodies characteristic of secondary immune response without production of interleukin-4 by immun T cells. Infect. Immun. 63 (7), 2596-2603.
Doch bei der Borreliose ist immer nichts, wie es sein sollte und man muss immer mit Ausnahmen rechnen. IgM-Antikörper, die ja eigentlich die „frühen“ Antikörper sein sollen, können über Monate bis Jahre bei fortschreitender Erkrankung mit Borrelien ansteigen, genauso wie die IgG-Antikörper.
Es gibt zahlreiche Belege, dass auch bei klinischer Erkrankung an Lyme-Borreliose keine Antikörper nachweisbar sein können.
Quelle:
Wilske, B., Bader, L., Pfister, H.W., Preac-Mursic, V., 1991. Diagnostik der Lyme-Neuroborreliose. Fortschr. Med. 22, 441-446.
Es gibt einen gut dokumentierten Fall von Borreliose, wo die DNA von Borrelia garinii im Blut und in der Synovialflüssigkeit eine eindeutige Diagnose erbrachte, man fand aber keine Antikörper gegen Borrelien bei diesem Patienten.
Quelle:
Dejmkova, H., Hulinska, D., Tegzova, D., Pavelka, K., Gatterova, J., Vavrik, P., 2002. Seronegative Lyme Arthritis durch Borrelia garinii. Clin.Rheumatol. 21 (4), 330-334
Ich beende diesen Beitrag mit einer Übersetzung von einem Paper, welches Prof. Morten M. Laane und Ivar Mysterud verfasst haben.
Department of Molecular Biosciences, University of Oslo, P.O. Box 1041 Blindern, 0316 Oslo, Norway
Dort heißt es:
„Die schwierigste Herausforderung ist die Diagnose. (…) Wir stellen die Hypothese auf, dass verschiedene Borrelien-Formen im sauerstoffreichen Blutstrom sich morphologisch anders zeigen, als im infizierten Gewebe und in Biofilmen, weil dort eine niedrigere Sauerstoffkonzentration herrscht.
Bewegliche Stadien können sich schnell in Zysten verwandeln oder aber auch dringen sie manchmal in andere Blutzellen ein, einschließlich der roten Blutkörperchen. Letztere sind ideale Verstecke für weniger bewegliche Stadien. Wir beschreiben die Interaktion zwischen dem Erreger und dem roten Blutkörperchen bekannt als „Host’s RBCs Blebbing-System“. Die weniger beweglichen Formen, die aus roten Blutkörperchen hervortreten und sich morphologisch stark unterscheiden, können sich einer Erkennung durch das Immunsytem entziehen, da sie mit Wirtsmembranproteinen teilweise beschichtet sind. (…) Eine Anfangsdiagnose, die sich bei vielen Borreliosepatienten durch mikroskopische Proben ergibt, ist schwierig zu bestätigen, weil auch die Labordiagnostik mit DNA-Techniken und immunologischen Methoden oft zu falsch negativen Ergebnissen und / oder Fehldiagnosen führt.“
Quelle:
“A simple method for the detection of live Borrelia spirochaetes in human blood using classical microscopy techniques”
Morten Laane und Ivar Mysterud
Eine einfache Methode für den Nachweis von lebenden Borrelienspirochäten im menschlichen Blut mit klassischer Mikroskopie-Technik

Liebe Nadine aufmerksam verfolge ich deine Wahrheiten. Bin ins Fegefeuer der schulmedi.gefangen leide schon 5 Jahre an irgendeinem chronischen. Immudefekt reichlich schmerzhaft würde mich gerne mit dir austauschen mir fehlt das gewisse I Tüpfelchen bitte melde dich bei mir vlg.conny