Anaplasma phagozytophilum gehört heute zu den Borreliose-Co.-Infektionen und wird auch durch Zecken (Ixodes ricinus) übertragen. Die meisten Anaplasmose-Patienten hören zum ersten Mal etwas von dieser Erkrankungsform beim „Borreliose-Arzt“. Wobei der Deutsche Bundestag 2017 bekannt gab: „In Deutschland ist bisher kein klinisch gesicherter Fall bekannt geworden.“
Quellen:
-
Auskunft des Nationalen Referenzzentrums für Borrelien vom 17. März 2017; vgl. auch Dobler, G./Fingerle, V./Hagedorn, P./Pfeffer, M./ Silaghi, C./Tomasom, H./Henning, K./Niedrig, M., Gefahren der Übertragung von Krankheitserregern durch Schildzecken in Deutschland in: Bundesgesundheitsblatt 2014, S. 541, abrufbar unter: http://edoc.rki.de/oa/articles/reotsY3VOfZV2/PDF/29cjum6zLlA5M.pdf (Stand: 28. April 2017)
-
Lyme-Borreliose Zahlen und Studien, Wissenschaftliche Dienste – Deutscher Bundestag, Sachstand: WD 9 – 3000 – 012/1, Aktenzeichen: WD 9-3000-012/17Abschluss der Arbeit: 28. April 2017 Fachbereich: WD 9: Gesundheit, Familie, Senioren, Frauen und Jugend
Diese Angaben beziehen sich auf die klinischen Symptome, aber nicht auf die Häufigkeit der Antikörper innerhalb der Bevölkerung.
Aber was sind die typischen Symptome einer Anaplasmose?
- Fieber
- Myalgien
- Schüttelfrost
- Thrombopenie (Abfall der Thrombozyten)
- Transaminasenerhöhung (Leberwerterhöhung)
- Kopfschmerzen
- Leukopenie, Anämie (Verminderung der Blutkörperchen)
- Schwindel
- Gewichtsabnahme
- Erbrechen
- Nackensteife
- Verwirrtheit
- Durchfälle
- Leibschmerzen
- Lymphknotenschwellungen
- Exanthem
Quelle: https://refubium.fu-berlin.de/bitstream/handle/fub188/6342/1_kap1.pdf?sequence=2&isAllowed=y Seite 17
Wobei die klinische Abgrenzung zur Lyme-Borreliose (neu: Borreliellose) recht schwierig sein müsste, da doch alle dieser aufgelisteten Symptome auch bei der Lyme-Borreliose beschrieben worden sind. Im weiteren Verlauf dieses Beitrags werde ich aber noch auf die Besonderheit der Anaplasmose eingehen.
Bei Hunden ist mittlerweile nachgewiesen, dass in manchen Regionen Deutschlands der Kontakt mit dem Erreger bei 40-50 Prozent liegt.

Quellen:
-
Barutzki D, De Nicola A, Zeziola M, Reule M. Seroprevalence of Anaplasma phagocytophilum infection in dogs in Germany. Berl Munch Tierarztl. Wochenschr 2006; 119: 342–7.
-
Jensen J, Simon D, Murua Escobar H, Soller JT, Bullerdiek J, Beelitz P, Pfister K, Nolte I. Anaplasma phagocytophilum in dogs in Germany. Zoonoses Public Health 2007; 54: 94–101.
-
Kohn B, Silaghi C, Galke D, Arndt G, Pfister K. Infections with Anaplasma phagocytophilum in dogs in Germany. Res Vet Sci 2011; 91: 71–6.
Auch bei mir melden sich immer mehr Menschen mit positivem Immun-Fluoreszenz-Test.
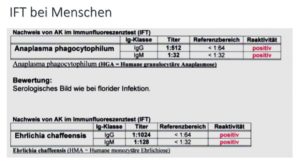
Mehr zum Thema der Verbreitung von Borreliose-Co.Infektionen unter:
Aber was zeichnet nun die Anaplasmose aus?
Um dies zu klären muss man sich mit diesem Bakterium näher auseinandersetzen.
Die humane granulozytäre Anaplasmose (HGA) wurde erst zu Beginn der neunziger Jahre in den Vereinigten Staaten entdeckt. Seit dieser Zeit wird sie allerdings als stetig zunehmende Erkrankung auch in Europa beschrieben. Wie der Name schon vermuten lässt befällt Anaplasma phagozytophilum die Immunzellen. Anaplasmen sind gram-negative, unbewegliche, vielgestaltige (pleomorphe) Bakterien mit einer Größe von 0,2 – 1,0 µm (andere Quellen sagen 0,2 – 0,4 µm). Zum Vergleich messen die fermenthaltigen Lysosomen der neutrophilen Granulozyten 0,2 – 0,5 µm im Einzeldurchmesser. Doch man kann das Bakterium Anaplasma phagozytophilum sehr gut von den Lysosomen der neutrophilen Granulozyten (weiße Blutkörperchen) unterscheiden, denn sie umhüllen sich mit Cholesterin und bilden außerdem sogenannte Einschlusskörperchen. Die ersten Forscher benannten die 2 – 5 µm großen Mikrokolonien „Morulae“ (lat. Maulbeeren), weil die Form der Kolonien sie an Maulbeeren erinnerte.
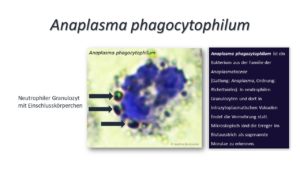
Was macht die Anaplasmose so problematisch?
Von unseren Immunzellen des Blutes gibt es verschiedene spezialisierte Zellen. Am allerhäufigsten von unseren weißen Blutkörperchen (Leukozyten) sind die neutrophilen Granulozyten, diese machen meist mehr als 65% der Leukozyten aus. Da der prozentuale Anteil sehr hoch ist, müssen also diese Zellen auch von besonderer Wichtigkeit für den Organismus sein.
Anaplasma phagozytophilum infiziert vornehmlich neutrophile Granulozyten, selten auch eosinophile Granulozyten und Monozyten. Nach der Infektion, die oft durch einen Zeckenstich herrührt, befällt Anaplasma phagozytophilum die Endothelzellen (Zellen der Innenseite der Blutgefäße), wie man es auch von den Bartonellen und Borreliellen her kennt. Nach ca. zwei bis sieben Tagen geht das Bakterium ins Blut über (Bakteriämie). Nun vergehen weitere Tage und nach ungefähr 14 Tagen kann man Einschlüsskörperchen (Morulae) in einigen der Granulozyten des peripheren Blutes sehen.

Wie kommen die Anaplasmen in die Immunzelle hinein und wieso überleben sie in diesen Zellen?
Diese unbeweglichen Bakterien kleben sich dafür direkt an der Oberfläche der Granulozyten fest. Die Granulozyten verschlingen die Anaplasmen über die Endozytose und so gelangen sie in die Zelle. Dort erhalten sie Nährstoffe und beginnen sich zu verdoppeln (binäre Teilung) und vermehren sich in Vesikeln (vom lateinischen „vesicula“ – Bläschen, in unserem Fall sind hier die Phagosomen gemeint) unter der Bildung von kleinen, kugelförmigen Kolonien, die als „Morulae“ bezeichnet werden. A. phagozytophilum zögert dabei den Zelltod der Granulozyten hinaus, um sich länger teilen zu können. Anaplasma veranlasst das Auflösen der Granulozyten (der infizierten Zellen), wenn genügend Anaplasmen entstanden sind. Die so neu gebildeten Erreger werden im peripheren Blut entlassen, um dort erneut weitere Granulozyten zu infizieren. Aber auch normale „Ausschleusung“ der Erreger (Exozytose) aus der Zelle wurde in mancher Literatur beschrieben. So werden es immer mehr Erreger und die „Brutstätte“ für neue Erreger sind vor allem die neutrophilen Granulozyten.
Quellen:
-
Untersuchungen zur Häufigkeit von Borrelia burgdorferi sensu lato, Anaplasma phagocytophilum und Babesia spp. in Ixodes ricinus aus Bayern und Baden-Württemberg, Inaugural-Dissertation zur Erlangung der tiermedizinischen Doktorwürde der Tierärztlichen Fakultät der Ludwig-Maximilians-Universität München von Sarah Leonhard aus Wiesbaden, München 2005
-
Prävalenz, Diagnostik und Bedeutung von Borrelia burgdorferi und Anaplasma phagozytophilum bei Hunden im Raum München, Inaugural-Dissertation zur Erlangung der tiermedizinischen Doktorwürde der Tierärztlichen Fakultät der Ludwig-Maximilians-Universität München von Charlotte Barth aus Heidelberg München 2013
-
Epidemiologische Studie zu zeckenübertragenen Krankheitserregern in Ixodes ricinus aus bayerischen Parkanlagen, Inaugural-Dissertation zur Erlangung der tiermedizinischen Doktorwürde der Tierärztlichen Fakultät der Ludwig-Maximilians-Universität München von Sabine Cornelia Poljak geb. Schorn aus Wolfratshausen, München 2012
Wie aber überleben die Anaplasmen in Immunzellen?
Anaplasma ist in der Lage bedeutsame Funktionen der neutrophilen Granulozyten-Abwehr zu hemmen, diese sind aber zur Beseitigung von Bakterien essentiell. Anaplasmen verhindern die Produktion von Superoxiden, die einen wesentlichen Teil der Abwehrmechanismen der Granulozyten ausmachen. Infizierte neutrophile Granulozyten produzieren keine Sauerstoffradikale mehr. Dies kommt der Anaplasmose zugute, um nicht selber „oxidiert“ zu werden. A. phagocytophilum vermindert zusätzlich die Beweglichkeit und die Bakterienverdauungs-Fähigkeit (Phagozytose) der Granulozyten. Außerdem zeigen die infizierten Granulozyten, dass sie weniger in der Lage sind sich an Blutgefäßwände anhängen zu können und die damit verbundene Durchquerung ins Gewebe findet weniger statt (Verminderung der Adhärenz an Endothelien und Transmigration).
Daher kann man die Anaplasmose auch als die „Immunschwächekrankheit aus dem Wald“ bezeichnen.

Welches System in den neutrophilen Granulozyten wird hierbei gestört?
Unsere neutrophilen Granulozyten können hochaktive Verbindungen herstellen, die sehr breitbandig wirken. Hierzu muss man wissen, dass neutrophile Granulozyten nicht nur Bakterien in ihrem inneren verdauen können, sie können auch Enzyme und chemische Verbindungen in das Blut oder das Gewebe abgeben und so den Organismus effektiv schützen. Genau in diese Prozesse greift Anaplasma phagozytophilum ein.

Die hauptsächliche Aufgabe von neutrophilen Granulozyten ist die Zerstörung von fremden Mikroorganismen, wobei hier einem Enzym namens Myeloperoxidase (MPO) eine wichtige Bedeutung zukommt. Dieses Enzym kann einerseits an negativgeladenen Mikroorganismen andocken und zum anderen kann es kurzlebige Antibiotika herstellen.
Bereits 1967 berichtete Klebanoff, dass MPO, Wasserstoffperoxid (H2O2) sowie Iodid-, Bromid-, Chlorid- oder Thiocyanat-Ionen ein potentes antimikrobielles System der neutrophilen Granulozyten bilden. So werden phagozytierte Mikroorganismen nicht nur durch lytische Enzyme getötet, sondern auch durch hochreaktive Sauerstoffverbindungen eliminiert. Die Myeloperoxidase (MPO) wird nach der Phagozytose mittels Degranulation aus den cytoplasmatischen Granula freigesetzt. Es oxidiert im Phagosom z.B. Chlorid mittels des im „Respiratory burst“ gebildeten H2O2 zu HOCl (Hypochlorigesäure). Die Myeloperoxidase katalysiert hier also zusammen mit ihrem Substrat H2O2 die Bildung von HOCl. HOCl ist der stärkste, bekannte, von neutrophilen Granulozyten produzierte, antimikrobielle Oxidant. Ein anderer hochpotenter Stoff, der auch in den neutrophilen Granulozyten gebildet wird, ist das Oxythiocyanat (auf Englisch: Hypothiocyanite), hier gibt es einen großen Anwendungsbereich nicht nur in der Pharmazie, sondern auch in der Lebensmitteltechnologie und im Biolandbau.

Sowie aber die Bildung von Wasserstoffperoxid im neutrophilen Granulozyten ausfällt, desto infektanfälliger wird man. Umso erschwerend ist es, wenn auch noch die Bildung der Peroxidase herabgesetzt wird, was ja z.B. bei Bleivergiftung oder Eisenmangel bekannt ist. Dies ist auch logisch zu erklären, denn das Zentral-Ion der Peroxidase ist das Eisen, wenn es fehlt oder durch Blei ersetzt wurde wirkt sich dies auf die Menge bzw. Qualität der Peroxidase aus.
Die Aktivität des „Peroxidase-Wasserstoffperoxid-Systems“ kann man übrigens auch messen und wird als biologischer Marker eingesetzt, um eine mögliche Schwermetallbelastung zu finden. Die Auswirkung von Blei-, Kupfer-, Quecksilber- und Cadmiumionen auf das Peroxidase-System in menschlichen neutrophilen Granulozyten im peripheren Blut zeigt sich als Unterdrückung/Hemmung der Peroxidase-Systemaktivität durch diese Metallionen.
Um es einfach zu formulieren: Neutrophile Granulozyten haben es schwer ihre Arbeit zu verrichten, wenn ihnen Eisen fehlt oder sie durch Schwermetalle oder Anaplasmen gestört werden.

EINFACH KLASSE!!!!!
Vielen lieben Dank! Und Grüße nach Holland!
Was soll ich sagen. Bei diesen Themen geht mir der Hut hoch und meine Nackenhaare streuben sich. Was kommt auf uns zu? Das Thema ist gut geschrieben und man kann es verstehen. Danke für die Auslegung. Grüße aus dem Bergischen. FQ
Wichtig ist, dass wir unseren Immunzellen helfen und ich sorge mich da etwas um die Bevölkerung. Liebe Grüße! Nadine