Seit ca. 6 Jahren überlege ich bereits einen Beitrag zu schreiben, in dem es um die zunehmende Erkrankung von roten Blutkörperchen (Erythrozyten) geht. Allerdings hatte ich immer das Gefühl, dass ich vielleicht zu sehr in ein unbequemes Gebiet der Wissenschaft eindringen könnte. Dennoch beschäftigt mich die Zunahme an parasitären Erscheinungsformen in und auf roten Blutkörperchen jetzt schon seit einigen Jahren tagtäglich, so dass ich heute ein paar Faktoren beleuchten möchte, die aber alle nicht dem „Mainstream-Verständnis“ entsprechen.
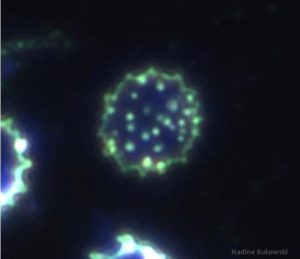
Wenn überhaupt dann wissen wohl die, die schon mal von Parasiten der roten Blutkörperchen gehört haben, am ehesten etwas von den Malaria-Parasiten. Die Jenigen, die aus der „Borreliose-Szene“ oder Medizin stammen, haben dann auch meist schon mal von Bartonella und Babesia gehört, auch diese Erreger benutzen rote Blutkörperchen als Nahrungsgrundlage und um sich vor dem Immunsystem zu verstecken. In anderen Beiträgen habe ich auch schon häufiger über intraerythrozytäre Borrelien geschrieben, die die lipidreiche Oberflächenmembran der Erythrozyten benutzen, um nicht vom Immunsystem erkannt zu werden.
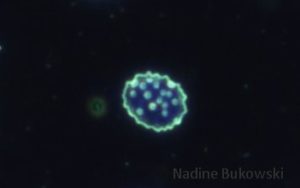
In den letzten Jahren, aber vor allem im letzten Jahr, stelle ich fest, dass man immer häufiger „hämotrophe Mycoplasma“ antrifft. Hämotrophe Mycoplasma kann man eigentlich nicht wirklich mit Bartonella verwechseln, auch wenn dies oft behauptet wird. Bartonella übt extrazellulär kreiselnde Bewegungen aus, was die Mykoplasmen nicht tun. Die Gemeinsamkeit ist aber, dass beide auf roten Blutkörperchen in der Mikroskopie zu finden sind. Auch verwechseln manche Menschen den Begriff „Mykoplasmen“ mit „Mykobakterien“. Hier in dem Text geht es aber nicht um Mykobakterien.
Ein alter Begriff für hämotrophe Mycoplasma ist übrigens Eperythrozoon coccoides, falls man noch alte Bücher im Regal stehen hat.
Die Bakterienform, über die ich heute schreibe, ähnelt morphologisch am allermeisten den „Mycoplasma suis“.
Infektionen beim Menschen mit tierspezifischen hämotrophen Mykoplasmen (Hämoplasmen) werden immer häufiger beschrieben.
Quelle: Pitcher DG, Nicholas RA. Mycoplasma host specificity: fact or fiction? Vet J 2005;170: 300-306.

Steckbrief des Bakteriums, um das es heute geht:
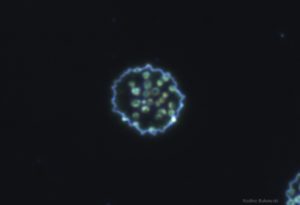
Wir haben es hier mit einem sehr kleinen Bakterium zu tun (ca. 0,3-3 μm im Durchmesser). Die Gestalt ändert sich je nach Alter des Bakteriums. Es ist unbeweglich und besitzt weder eine Zellwand, noch Flagellen, außerdem ist es lediglich von einer einfachen Membran umgeben. Im Zytoplasma des Bakterienkörpers befindet sich eine sehr kleine Granula/Körnchenschicht, Vakuolen und filamentöse Strukturen. Einen Zellkern besitzt es nicht. Im Blut findet man diese vorwiegend auf der Oberfläche der Erythrozyten, bei hoher Bakterienzahl auch frei im Plasma. Die Vermehrung ist eine klassische Verdopplung, also eine binäre Teilung.
Im Mikroskop sieht man drei morphologische Formen. Zu Beginn tritt eine unreife, kleine, kokkoide Form auf, es folgt eine diskoide Form (diskus-ähnliche Form), während sich die ausgereiften Bakterien ringförmig mit einer tiefzentralen Einziehung zeigen.
Quellen:
Messick JB. Hemotrophic mycoplasmas (hemoplasmas): a review and new insights into pathogenic potential. Vet Clin Pathol 2004;33: 2-13.
Zachary JF, Basgall EJ. Erythrocyte membrane alterations associated with theattachment and replication of Eperythrozoon suis: a light and electron microscopic study. Vet Pathol 1985;22: 164-170.
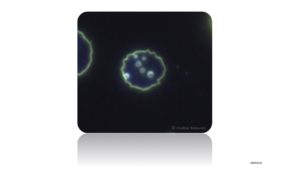
Fast schon ein Virus
Alle Bakterien die einen Durchmesser von unter 1000nm besitzen können sehr gut Sterilfilter (die kleinste Porengröße der Filter liegt meist bei 2,2µm) passieren und können daher leicht übertragen werden. Da diese kleinsten Mykoplasmen ca. 300nm messen, liegen sie nahe der Minimalgröße für eigenständige Vermehrung. Zum Vergleich misst das EB-Virus knapp unter 200nm.
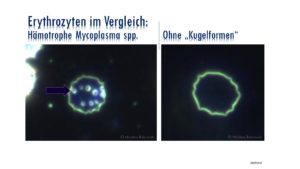
Lebensgewohnheiten
Wie der Name schon sagt kleben sich hämotrophe Mycoplasma immer an die roten Blutkörperchen, was auch lebensnotwendig für diesen Parasiten ist, um an seine Nährstoffe zu gelangen. Die Anheftung der Mycoplasma suis an die Erythrozyten führt dabei zu irreversiblen Schäden der Zellmembranen. Dies ist aber nicht bei allen hämotophen Mycoplasma gleich, manche schädigen die Oberfläche nur minimal. Hier in diesem Text geht es aber nun darum einen aggressiveren Keim vorzustellen und dies ist nun mal Mycoplasma suis und seine nahen genetischen Verwandten.
Die Veränderungen an der Membran führen zur Freilegung von Membranstandteilen. Durch den Abbau der veränderten Erythrozyten durch Makrophagen in Leber und Milz kommt es zu einem Abfall der Erythrozyten-Werte im Labor bzw. im Körper.
Der Entzug von Nährstoffen führt bei infizierten Erythrozyten zu einer reduzierten Energieproduktion. Der daraus resultierende oxidative Stress bedingt eine verkürzte Lebensspanne der Zelle (Versteifung der Zellmembran) und somit eine vorzeitige Entfernung aus der Blutbahn, es kommt zur Anämie (Blutarmut).
Bei der Entstehung der Anämie während einer solchen Infektion ist die Bildung von autoreaktiven Antikörpern der Klassen IgG und IgM gegen Erythrozyten-“Antigene“ beschrieben worden.
Quellen:
Hoelzle LE, Zeder M, Felder KM, Hoelzle K. Pathobiology of Mycoplasma suis. Vet J 2014: 20-25
Hoffmann R, Schmid DO, Hoffmann-Fezer G. Erythrocyte antibodies in porcine eperythrozoonosis. Vet Immunol Immunopathol 1981;2: 111-119.

Bildung von Autoimmunerkrankungen durch Ruptur der Erythrozyten-Membran
Normalerweise sind die Eiweiße des Zytoskeletts (zytoskeletale Proteine) unzugänglich für die Immunzellen des Blutstroms. Wenn es aber zu einer Verletzung der Erythrozyten-Membran kommt reagieren unspezifische B-Lymphozyten darauf. Diese B-Zellen differenzieren sich zu Plasmazellen, welche autoreaktive IgG-Antikörper gegen eigene Erythrozyten-Bestandteile bilden können.
Nun gibt es leider auch noch Strukturproteine (Aktin), die eben nicht nur im Stützskelett der roten Blutkörperchen zu finden sind, sondern auch an anderen Stellen des Körpers. α-Aktin kommt in Muskelzellen vor, β-Aktin ist im Zytoskelett verschiedenster Zellen zu finden. Zirkulierende Autoantikörper können hier zu Schäden führen.
Quellen:
Felder, K. M., Hoelzle, K., Heinritzi, K., Ritzmann, M. and Hoelzle, L.E., 2010. Antibodies to actin in autoimmune haemolytic anaemia. BMC Veterinary Research 6, 18
Khan, F.Y. and Yassin, M.A., 2009. Mycoplasma pneumoniae Associated with Severe Autoimmune Hemolytic Anemia: Case Report and Literature Review. Brazilian Journal of Infectious Diseases 13,77-79.
Ein relativ simpler Nachweis auf zirkulierende Autoantikörper ist, wenn man Blut in ein Reagenzglas füllt und mit einer Büroklammer verschüttelt. Sollten sich dann sofort „Verleihmungen“ (Agglutionationen) von Erythrozyten im mikroskopischen Bild zeigen, so ist dies der Beweis, dass sich bereits Autoantikörper im Blut befanden. Dies ist eine sehr alte Testmethode und findet heute nur noch in der Medizin Anwendung in Regionen, wo elektrischer Strom nicht immer vorhanden ist. Wer den Test einmal ausprobieren möchte, der sollte sich mind. noch eine Blutprobe eines anderen Probanden besorgen, damit man die Ergebnisse auch vergleichen kann. Wichtig ist, dass zeitnah dann mikroskopiert wird, damit im Mikroskop über die nächsten 30-60 Minuten die mögliche Zusammenlagerung beobachtet werden kann.
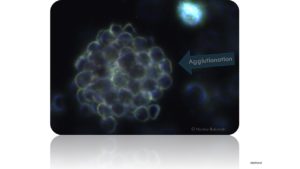
Krankheitsformen durch hämotrophe Mycoplasma
Die Bildung von wärmereaktiven IgG-Antikörpern in der frühen Phase der Infektion führt zur sogenannten „Auto-Immunen- Hämolytischen-Anämie (abgekürzt: AIHA). In der chronischen Phase der Infektion können vor allem autoreaktive Kälteagglutinine der Klasse IgM nachgewiesen werden, die sich gegen Karbohydrat-Antigene auf der Erythrozytenoberfläche richten.
Quellen:
Warm autoimmune hemolytic anemia following recurrent mycoplasma pneumonia infections in a child with Down syndrome.
https://www.ncbi.nlm.nih.gov/pubmed/18850483
Mycoplasma pneumoniae associated with severe autoimmune hemolytic anemia: case report and literature review.
https://www.ncbi.nlm.nih.gov/pubmed/19578637
Cold agglutinin hemolytic anemia complicating mycoplasma pneumonia
https://www.ncbi.nlm.nih.gov/pubmed/1433920
Test auf autoreaktive Kälteagglutinine
Auch dieser Test lässt sich relativ leicht selber nachstellen. Hier verdünnt man Blut mit BukoVitaN® oder einer anderen isotonischen Lösung und stellt die gut vermengte Probe für eine Nacht in den Kühlschrank. Wichtig ist hier, dass man die Probe auch mikroskopiert, bevor sie in den Kühlschrank kommt, um eine Vergleichsmöglichkeit zu haben.

Hypoglykämie
Mycoplasma benötigt vor allem Traubenzucker. Der Entzug wirtseigener Glukose für den Bakterien-Energiestoffwechsel kann bis zu einer Hypoglykämie (verminderte Blutzuckerwerte) führen.
Veränderung der roten Blutkörperchen
Eine hämotrophe Mycoplasma-Infektion zeigt sich nicht nur durch die Anwesenheit der Bakterien auf den Erythrozyten, sie ist auch gekennzeichnet durch Zellschrumpfung, „Blebbing“ der Zellmembran, Aktivierung von Proteasen (Zerstörung des Zytoskeletts) und Geldrollenbildung.
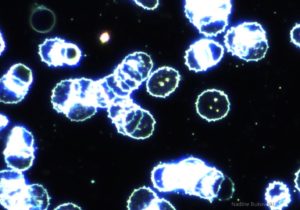
Übertragungswege
Die Übertragung von hämotrophen Mykoplasmen erfolgt meist direkt ins Blut, z.B. über Kanülen, aber auch blutsaugende Arthropoden kommen als Vektoren in Betracht (Mücken, Läuse, Räudemilben und Stechfliegen).
Als nächstes gelangt der Erreger erstmal in die Endothelzellen der Blutgefäße, wie auch bei Bartonella oder Anaplasma dies der Fall ist.
Aber auch orale Übertragungen sind sehr wahrscheinlich, alleine schon wegen der sehr geringen Bakteriengröße.

Häufiges Auftreten?
Hierzu gibt es keine verlässlichen Angaben. Was ich aber präsentieren kann, ist dass in den Jahren 1991-2011 in China 28,51% der getesteten Menschen einen positiven Hämoplasmen-Befund hatten.
Quelle:
Huang DS, Guan P, Wu W, Shen TF, Liu HL, Cao S, Zhou H. Infection rate of Eperythrozoon spp. in Chinese population: a systematic review and meta-analysis since the first Chinese case reported in 1991. BMC Infect Dis 2012;12: 171
In Shanghai konnte bei 49% der getesteten Personen aus Berufsgruppen mit häufigem Tierkontakt eine Genvariante ermittelt werden, die zu 98% homolog zu denen von Mycoplasma suis waren.
Schlussworte
Am Ende dieses Textes möchte ich kein Fazit nennen. Ich denke, dass ich anderen die Entscheidung überlasse, wie man mit solchen mikroskopischen Bildern umgehen sollte. Ich kann nur immer wieder zeigen, was man mit einem Dunkelfeld-Mikroskop sehen kann, aber die Interpretation, ob relevant oder nicht, ist nicht meine Aufgabe.

Hervorragend gezeigt, beschrieben und objektiv interpretiert!!! Einfach Klasse!!!
Vielen Dank lieber Rein!
Ich bedanke mich für deine Ausführung, hat mir gefallen. Dieses Gebiet ist spannend und es wird mich immer wieder faszinieren. Gruß Friedhelm
Hallo lieber Friedhelm, vielen Dank für dein Interesse. Dieses Gebiet ist auch so facettenreich, dass es niemals langweilig wird. Alles Gute! Nadine